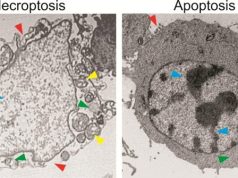
Sonbaharda zamanı gelince sararmış yapraklar nasıl dökülürse vücudumuzda da ölmesi gereken hücreler sessiz bir şekilde ölürler. Dengeyi sağlayan, çevresine zarar vermeden hücrenin bu ölümüne apoptoz diyoruz. Peki, anne rahminde başlayıp yaşamın son anına kadar devam eden apoptoz nedir?
Mustafa Güven / Sinirbilim
Apoptoz, gelişimde ve yaşlanmada rol alan bir hücre ölüm mekanizmasıdır. Embriyonel gelişimde organ ve dokuların gelişmesinde apoptoz görülür buna el ve ayak parmaklarının oluşması güzel bir örnektir. Yetişkin bir organizmada ise hücre yapım ve yıkımında dengeyi sağlayarak homeostazın devamlılığını sağlar. Hücrenin kendisi tarafından orkestre edilen apoptozda hiçbir dokuya zarar verilmeden hücre ölümü gerçekleşir. Klasik tabirle programlı hücre ölümüdür. Hücre içi ve dışı pek çok faktörle denetim altında olan apoptoz yaşam için fazlasıyla öneme sahiptir ve işleyişinde meydana gelen problemler geniş bir yelpazede sorunlara yol açabilir; çünkü apoptoz, anne rahminde başlayan ölümle sonuçlan hayat sürecinde devam eder.
İçindekiler
Fizyolojik Apoptoz
İnsan vücudunda her an hücre yapımı ve yıkımı devam eder. Kararlı bir iç dengenin de sürdürülebilmesi için kritik bir öneme sahip bu yapım-yıkım süreci temel olarak mitoz bölünme ve apoptozla sağlanır. Apoptoz daha önce de bahsettiğimiz gelişimsel süreçte rol alır ayrıca bağışıklığın sağlanmasında, yara iyileşmesinde de görülmektedir. Apoptoz gelişimsel süreçlerde, yaşlanmada ve hastalıklarda artabilir.
Patolojik Apoptoz
Hücre ölümünün düzenlenmesindeki düzensizlikler Alzheimer, Parkinson hastalığı gibi nörodejeneratif hastalıklara, otoimmün hastalıklara, AIDS ve kanser gibi pek çok hastalığa sebep olabilir. Bazı hastalıklarda apoptoz düzeyi düşükken bazı hastalıklarda yüksektir.
Apoptoz seviyelerinde meydana gelen değişikliklerin insan yaşamını tehdit eden ve yaşam kalitesini düşüren hastalıklara sebep olduğu göz önüne alındığında sıkı bir şekilde düzenlenmesi gerektiği açıktır.
Apoptozun Moleküler Mekanizması
Apoptoz genetik ve epigenetik mekanizmalarla sıkıca kontrol edilmektedir. Apoptozun erken safhalarında hücre yüzeyinde bazı belirteçlerin ekspresyonu görülür ve bu belirteçlerin ekspresyonu inflamasyona sebep olmadan hücrenin fagosite edilmesini sağlar. Doku harabiyetine sebep olmadan hücre ölümünün gerçekleşmesinde bu durum önemli rol almaktadır. Apoptozun ve bir başka hücre ölümü olan nekrozun gerçekleşmesinde tespit edilen biyobelirteçler olmasına karşın hücre ölümünün sınıflandırılmasında doğrudan morfoloji üzerinden yapılan sınıflandırma daha doğru bir yöntemdir.
Kaspazlar
Yüzey belirteçlerinin hücre zarında yerleşmelerini takip eden süreci DNAase enziminin DNA’yı yıkması takip eder. Kaspaz adı verilen enzimler DNA’nın yıkımını sağlayacak olan DNAase enzimini aktive ederler. Sistein proteaz ailesinden olan kaspaz enzimleri aktive olduklarında hücre için hayati önemdeki proteinleri ve hücre iskeletini yıkarlar. Kaspaz enzimlerinin aktivasyonu apoptoza özel olmakla birlikte farklı görevlere sahip üyeleri vardır. Kaspazlar, kaspaz-1 ve apoptozda rol oynayan kaspazlar olarak iki gruba ayrılırlar. Kaspaz 1’ler inflamatuar süreçlerde rol alırlar. Apoptozla ilgili olan kaspazlar da ikiye ayrılırlar: başlatıcı (kaspaz-2, kaspaz-8, kaspaz-9, kaspaz-10) ve yıkımda etkili olan kaspazlar (kaspaz-3, kaspaz-6, kaspaz-7). Apoptozda önemli role sahip kaspazların seviyelerindeki düşme, apoptozun azalması ve karsinogenez anlamına gelebilir.
Kaspazlar:
- Kaspaz-1
- Apoptozla ilgili Kaspazlar:
- Başlatıcı (2, 8, 9, 10)
- Yıkımda etkili (3, 6, 7)
Kaspaz seviyeleri karsinogenezde önemli olmakla birlikte ilaç direncinde de rol almaktadır. İnhibitör apoptoz proteinleri (IAP) kaspazları, doğrudan kaspazları yıkarak veya substratlarından uzaklaştırarak inhibe ederler. IAP’ların anormal ekspresyonu kemoterapiye karşı gelişen dirençten sorumludur.
Tedavi yaklaşımlarında kaspazların aktivasyonunu hedefleyen yaklaşımlar bulunmaktadır. Bunlardan bazıları kaspazları düzenleyen faktörleri hedefler. IAP’lardan biri olan XIAP’ı hedefleyen çalışmalar buna örnek verilebilir. Ayrıca pro-apoptotik olan bazı küçük moleküller (small molecules) prokaspaz-3’ün doğrudan aktivasyonunu sağlayabilir. Kaspaz-3’ün her yolakta kavşak nokta olması bu seçimi mantıklı kılabilir.
Apoptoz her hücrede görülebildiği için apoptozu hedefleyen terapilerde normal hücrelerin de etkilenmesiyle ortaya çıkan ciddi yan etkiler sorun oluşturmaktadır. Yapılan yeni çalışmalarda apoptozun seçici olarak tetiklendiği moleküller ve yaklaşımlar geliştirilmeye çalışılıyor.
Bcl-2 Protein Ailesi
Mitokondri membranında yerleşen ve intrinsik apoptoz yolağını kontrol eden, pro- ve anti- apoptotik protein gruplarını içeren Bcl-2, bir protein ailesidir. Bcl-2 protein ailesi mitokondriyal membran geçirgenliğini kontrol etmektedir.
Karsinogenezde Bcl-2 ailesinin de etkisi vardır. Bcl-2 ailesine ait pro- ve anti-apoptotik protein dengesinin bozulması hücrenin apoptozdan kaçışında bir mekanizmadır. Diğer apoptozdan kaçış mekanizmalarına kaspaz aktivasyonunun azalması, bozulmuş ölüm reseptör sinyal yolları örnek olarak verilebilir.Pek çok kanserde pro-apoptotik olan bax geninde mutasyon görülürken anti-apoptotik Bcl-2 proteinlerinde artış saptanmıştır.
Hücre ölüm mekanizmasında hatanın gerçekleştiği basamaklar tedavi için hedef konumundadırlar. Bu amaçla Bcl-2 proteinlerinin doğrudan hedeflendiği veya Bcl-2 genlerinin susturulduğu çalışmalar bulunuyor.

p53 Proteini
TP53 geni tarafından kodlanan p53 proteini birçok genin ekspresyonunu kontrol eden bir transkripsiyon faktörüdür. Hem ekstrinsik hem de intrinsik apoptotik yolaklarda da görevli olan p53, apoptozun yanı sıra hücre döngüsünün kontrolünde, DNA hasarının belirlenmesinde, DNA tamirinde ve senesende yani hücre yaşlanmasında düzenleyici olarak görev alır. Sağlıklı hücrelerde p53 düzeyleri normalken p53’ün denetlediği herhangi bir hücresel olayda meydana gelen sorunlar p53 seviyelerini yükseltmektedir. p53 sağlıklı hücrelerde genellikle pro-apoptotik proteinlerin transkripsiyonunu doğrudan aktive eder. Tümör süpresör bir protein olan p53’ün mutasyonu kanserde en sık görülen genetik dönüşümdür.
Apoptoz Yolakları
Apoptozun meydana gelmesinde intrinsik/mitokondriyal, ekstrinsik ve T hücre aracılı ölüm yolakları görülür. Her ne kadar birbirlerinden farklı yolaklar olsalar da birbirleriyle sıkı bir ilişki içindedirler.
İntrinsik veya Mitokondriyal Yol
Radyasyon, hipoksi ve toksinler gibi etkenler apoptozu intrinsik yolla başlatabilir. İntrinsik yolda uyaran ne olursa olsun mitokondriyal zar geçirgenliği artar ve sitokrom-c gibi pro-apoptotik yani hücreyi apoptoza götüren moleküller sitoplazmaya salınır. Sitokrom-c’nin sitoplazmaya salınmasını daha önce bahsettiğimiz Bcl-2 protein ailesi kontrol etmektedir. Sitoplazmaya salınan sitokrom-c, kaspaz-9 ile birlikte apoptozom adı verilen yapıyı oluştururlar. Apoptozom da kaspaz-3’ü aktive ederek hücre ölümünün son basamağını başlatır.
Ekstrinsik Yol
Ekstrinsik yol, belirli ölüm ligandlarının ölüm reseptörleriyle bağlanmasıyla başlar. Bu bağlanma adaptör proteinler için bağlanma bölgesi oluşturur. Ligand-reseptör-adaptör protein üçlüsü birleşerek DISC (death-inducing signalling complex)’i oluştururlar. DISC de pro-kaspaz 8’i aktive eder böylece apoptoz ekstrinsik yolla başlamış olur. Kaspaz-8’den sonra kavşak nokta olan kaspaz-3 aktive olur ve her hücre ölüm yolağında görülen son süreç başlar. DNA ve hücre iskeletinin yıkılır ve bunu kromatin ve sitoplazma yoğunlaşması takip eder. Apoptotik cisimciklerin oluşumu ve fagositoz ile süreç sona erer.
T-Hücre Aracılı Yol
T hücre aracılı hücre ölümü, CD8+ yani sitotoksik T hücrelerinin antijen taşıyan hücreyi öldürmesidir. Bu sitotoksik T hücreleri genellikle ekstrinsik yolla hücreyi öldürürler. Ayrıca T hücresi doğrudan perforin salgılayarak hedef hücrenin membranında kanallar açılmasını sağlar. Perforin salgısının hemen ardından proteaz olan granzim A ve granzim B enzimlerini içeren sitoplazmik granülleri hedef hücrenin içerisine gönderir. Böylelikle hücrenin ölümü sağlanmış olur.
Kaynaklar
- Makale– Kiraz, Yağmur et al., Major apoptotic mechanisms and genes involved in apoptosis. Tumor Biology, 2016
- Makale– Elmore, Susan A, Apoptosis: a review of programmed cell death. Toxicologic pathology, 2007
- Makale– Green, Douglas R., The Coming Decade of Cell Death Research: Five Riddles. Cell, 2019
- Makale– Wong, Rebecca S. Y., Apoptosis in cancer: from pathogenesis to treatment. Journal of experimental & clinical cancer research: CR, 2011
- Makale– Aubrey, Brandon J et al., How does p53 induce apoptosis and how does this relate to p53-mediated tumour suppression? Cell Death and Differentiation, 2018
- Fotoğraf– Memorial Sloan Kettering Cancer Center, What Is Apoptosis?
www.sinirbilim.org/apoptoz